2025/11/21
点击次数:1353
监测方法与规范
植物多样性监测包含复杂的系统工序,涉及样地选择、样方设置、群落指标调查(性状测量、物种鉴别)、理化分析和数据处理等系列过程,任何一个环节出问题,都会影响监测数据的质量以及后续分析结果的可靠性。因此,监测方法的规范性、统一性至关重要。本章重点介绍群落监测与调查环节的具体操作方法和规范。
1物种组成和结构特征
1.1草本植物群落
监测指标包括物种中文名、物种学名、株(丛)数、营养枝平均高度、生殖枝平均高度、植株平均高度、盖度、地上生物量、地下生物量和物候期等。具体监测方法如下。
(1)物种中文名和物种学名:人工调查,逐一鉴定样方内物种种类,推荐参考“Species 2000”的确定植物中文名称和学名。样地内所有物种均要在样方外去采集标本,并邀请分类专家进行鉴定,避免野外物种鉴定出现错误,最后作为该样地档案的一部分予以妥善保管。通常,初次调查需要采集的标本较多,以后复查监测时只采集新增加的物种标本,或者花果等更齐全的标本就可以。对调查样方外的物种以及样地周边的物种也进行记录,所有物种信息汇入样地物种名录表(样地物种名录表的具体字段见表5-6)。
(2)株丛数:人工调查,对三级样方(1 m×1 m)内每种植物的株丛数进行计数。生活型不同的植物,其株丛数计数方法不同。根茎型的禾草,如羊草,每个独立克隆分株记作一株;丛生型禾草,如大针茅,按丛计数;团垫状植物,如垫状驼绒藜、冷蒿,按斑块计数,并记录斑块的长轴和短轴尺寸;轴根型杂类草,如麻花头(Klasea centauroides),按株计数。
(3)营养枝平均高度:人工调查,选取处在营养生长状态的植株,确定高、中、低三类高度的植株,每类选择3株以上,采用钢卷尺测量其垂直高度,求其平均值。
(4)生殖枝平均高度:人工调查,选取具有花、果的植株,确定高、中、低三类高度的植株,每类选择3株以上,采用钢卷尺测量其垂直高度,求其平均值。
(5)植株平均高度:人工调查,确定高、中、低三类高度的植株,每类选择3株以上,采用钢卷尺测量其垂直高度,求其平均值。
(6)盖度:分种测量每种植物的盖度值,通常用百分比表示。盖度常用目测法估计,并以百分数表示。不过,目测法是一种主观性判断方法,不同人的目测结果可能会有较大的差异。因此,要求目测人员具有丰富的野外植被调查经验,在野外调查中最好由三人分别目测,然后进行讨论,每个人修正自己的目测估值,最后求均值。
除了目测法以外,还有图解样方法。图解样方法要在植物群落地段内设置一定面积的样框(一般为1 m2),其中分隔成许多相等的小块,并加以坐标编号;另用坐标纸在上面按比例定出样框边线,这样每株植物冠幅及基部枝条的轮廓所占的面积就可以十分精确的描绘在坐标纸上。
此外,还可以采用数码相机垂直向下对植被进行拍照,获取植物群落的照片,利用Photoshop软件或者其他软件(如SamplePoint)提取出植物组分,进而计算出植被盖度。用于盖度分析的数码照片最好在阴天、多云天等没有阳光直接照射的情况下拍摄,尽量减少阳光照射对分析结果的影响。在无法避免阳光照射的情况下,在进行图像分析时需注意识别处在阴影里的植物组分以及高反射发亮部分的植物组分。
(7)地上生物量:采用收获法在缓冲区的生物量调查样方(三级样方)内用剪刀齐地面剪取每种植物的地上部并分种装入纸袋,标明样地代码、样方编号及物种名称,带回实验室烘干至恒重后称量获得地上生物量。对于物种分布较为均匀、密度较大的草甸或者草甸草原,生物量的收获面积可适当减小到0.5 m × 0.5 m。在实验室进行地上生物量称量时须准确记录样地代码、样方编号、物种名称及生物量数值,然后汇入草本植物群落或草本层调查数据表。
(8)地下生物量:采用根钻法进行地下生物量调查,利用直径不小于5 cm的根钻,每个样方取3钻,钻孔均匀分布,取样深度为70 cm,分层采集根系样品(0~10 cm、10~20 cm、20~30 cm、30~50 cm、50~70 cm),装入根袋,标明样地代码、样方编号及取样深度,清洗干净后,带回实验室烘干至恒重后称量获得地下生物量。在实验室进行地下生物量称量时须准确记录样地代码、样方编号、取样深度及生物量数值,然后汇入草本植物群落或草本层调查数据表。
(9)物候期:人工记录调查时每种植物所处的物候期。具体物候期确定方法参考吴冬秀等(2019)编制的《陆地生态系统生物观测指标与规范》相关内容。
各个监测指标的调查数据填入表1。调查过程中拍摄的植物照片号和所采集的植物标本号填入记录表。
表1草本植物(层)群落调查表
第 页
样地代码 样方编号 样方尺寸 m× m 盖度 %
调查日期 年 月 日 时 调查者
物种中文名 | 物种学名 | 株数 | 营养枝平均高度/cm | 生殖枝平均高度/cm | 植株平均高度/cm | 盖度/% | 物候期 | 照片号 | 标本号 | 备注 |
| | | | | | | | | | |
| | | | | | | | | | |
| | | | | | | | | | |
| | | | | | | | | | |
| | | | | | | | | | |
| | | | | | | | | | |
| | | | | | | | | | |
| | | | | | | | | | |
| | | | | | | | | | |
1.2灌木群落
灌木群落中灌木的监测指标包括物种中文名、物种学名、株高、基径、冠幅(长轴长度和短轴长度)、地上生物量、地下生物量和物候期等。灌木群落中的草本层监测方法同草本群落。灌木群落具体监测方法如下。
(1)物种中文名和物种学名:进行人工调查时,逐一鉴定样方内物种种类,推荐参考“Species 2000”确定植物中文名称和学名。样地内所有物种均要采集标本,并邀请分类专家进行鉴定,避免野外物种鉴定出现错误。对调查样方外的物种以及样地周边的物种也进行记录,所有物种信息汇入样地物种名录表。
(2)株高:采用钢卷尺测量植株的垂直高度。
(3)基径:采用游标卡尺测定灌木植株贴近地面处茎基部的直径,至少垂直交叉测量一次,基径较大的灌木可以使用胸径尺测量。
(4)冠幅:采用钢卷尺或皮尺分别测量每丛灌木冠幅的长轴长度和短轴长度。
(5)地上生物量:根据调查获取的株高、基径和冠幅等数据,采用生物量模型进行计算。有条件的地方,可以采用收获法获得地上生物量,构建生物量模型,如不能自己建模,可以使用已发表的生物量模型进行计算。在实验室进行地上生物量计算时须准确记录样地代码、样方编号、物种名称及生物量数值,然后汇入灌木层调查数据表。
(6)地下生物量:采用生物量模型进行计算。有条件的地方,可以采用收获法获得地下生物量,构建生物量模型,如不能自己建模,可以使用已发表的生物量模型进行计算。在实验室进行地下生物量计算时须准确记录样地代码、样方编号、物种名称及生物量数值,然后汇入灌木层调查数据表。
(7)物候期:记录调查时每种植物所处的物候期。具体物候期确定方法参考吴冬秀等(2019)编制的《陆地生态系统生物观测指标与规范》相关内容。
各个监测指标的调查数据填入表2。
灌木群落中的草本层调查使用草本植物群落调查表进行记录。植物照片号和标本号填入记录表。
表2灌木(层)群落调查表
第 页
样地代码 样方编号 样方尺寸 m× m 盖度 %
调查日期 年 月 日 时 调查者:
物种中文名 | 物种拉丁名 | 株高 /m | 基径 /cm | 冠幅长轴长度/cm | 冠幅短轴长度/cm | 物候期 | 照片号 | 标本号 | 备注 |
| | | | | | | | | |
| | | | | | | | | |
| | | | | | | | | |
| | | | | | | | | |
| | | | | | | | | |
| | | | | | | | | |
| | | | | | | | | |
| | | | | | | | | |
| | | | | | | | | |
1.3乔木群落
乔木群落中乔木层的监测指标包括物种中文名、物种学名、株高、胸径、冠幅(长轴长度和短轴长度)、地上生物量、地下生物量和物候期等。乔木群落中的灌木层和草本层监测方法同灌木群落和草本植物群落(具体见本章1.1和1.2节)。乔木层具体监测方法如下。
(1)物种中文名和物种学名:人工调查时,逐一鉴定样方内物种种类,参考“Species 2000”确定植物中文名称和学名。采集植物标本,并邀请分类专家进行鉴定,避免野外物种鉴定出现错误。对调查样方外的物种以及样地周边的物种也进行记录,所有物种信息汇入样地物种名录表(样地物种名录表的具体字段见表5-6)。
(2)株高:常用方法有目测法、测高杆法和激光测距法。简要介绍如下(引自吴冬秀等(2019)编著的《陆地生态系统生物观测指标与规范》)。
①目测法。目测一般采取积累法和分割法。积累法:即树下站一人,举手为2 m,然后以2、4、6、8、10往上累计直至树梢。分割法:即测量者站在距树远处,把树分割为1/2、1/4、1/8、1/16,如果分割至1/16处树高为1.5 m,则树高可估测为1.5 × 16=24 m。
②测高杆法。测高杆比较适合于树干较直的个体,测量人手持测高杆,从最下面读出1 m以下的实际刻度,并由另一人在高坡位用望远镜观察、核对测高杆与树梢是否水平。
③激光测距仪法。采用激光测距仪来测量树高,其原理是应用激光传输的时间来计算距离,能快速稳定地获得可靠、准确的距离、高度数据。激光测距仪测高要求同时看到在可测量范围的树干和树木顶端。对于冠层特高、不易对准树梢的树木,也可以目测树干1/2高处的位置,用激光测距仪测定该高度后再乘以2获得树高数据。
注意事项:
(1)异常木的树高测定。如果遇到非直立树高测量时需要进行调整,总的原则是:
①最高点以树木最高处的顶芽为准;
②树木斜生或弯曲时,树高测量是测量树木的实际长度,而非垂直高度。
(2)目测树高的注意事项:
①目测树高与观测人员的经验有很大关系。因此,不仅要保证调查人员固定,而且要加强对调查人员的实践训练,培养其对树高目测的感性认识,以增加经验、减少误差、提高准确性。
②选取适当的参照物。利用方便测量高度的物体,如已知高度的电线杆、观测铁塔等作为参照物进行树高的估计。
③在能看清楚树冠的地方进行目测。在植株密度较大、视线不佳、看不到树梢的情况下,可站在高坡位用望远镜核对。
④调查人员站位与被测树木距离不宜过大或过小。一般是水平距离与树高大约相等或稍远些,即观测树梢的迎角最好在45度左右,否则会产生较大误差。在坡地上测树高,调查人员最好与被测树木处在等高和稍高位置。
(3)胸径:胸径一般采用胸径尺或游标卡尺直接测定。用普通卷尺测量的,务必准确记录为周长并除以π(3.14159)后转换成为直径。
注意事项(引自吴冬秀等(2019)编著的《陆地生态系统生物观测指标与规范》)
(1)不同情形下树木胸径的测量位置见图1,总的原则是:
①上坡位测量;
②树干倾斜≤45°时按平行树干方向1.3 m处定位;
③倒木按树干直立时地上1.3 m处定位;
④胸高位置有树枝或结疤,在影响小的1.3 m以上或以下30 cm处定位,备注说明实测胸高位置;
⑤出现根蘖繁殖或板根现象时,在根基向上1.3 m处定位。
⑥1.3 m以下分叉的树木,测量每个分枝距地1.3 m处的直径,并作备注说明。
(2)胸径尺和游标卡尺应紧贴树干。如测量位置出现树皮剥落或翘起,苔藓、藤本或附生植物生长等情况,原则上应先除去或磨平,消除外围影响。
(3)为获取准确的测量数据,可两次在树干上交叉测量取平均值,以减少误差。尤其对于使用游标卡尺测量胸径为10 cm以下的形状不规则的树干个体时,要求至少垂直交叉测量一次。
(4)边界个体的处理。由于样方相对较小,边界个体的处理会对调查结果产生较大的影响。对于位于样方边界的个体,一般判断原则是:如果边界个体的树干50%以上位于样方边界内,则应该计数并测量记录;如果边界个体的树干50%以上位于样方边界外,则不计入样方。
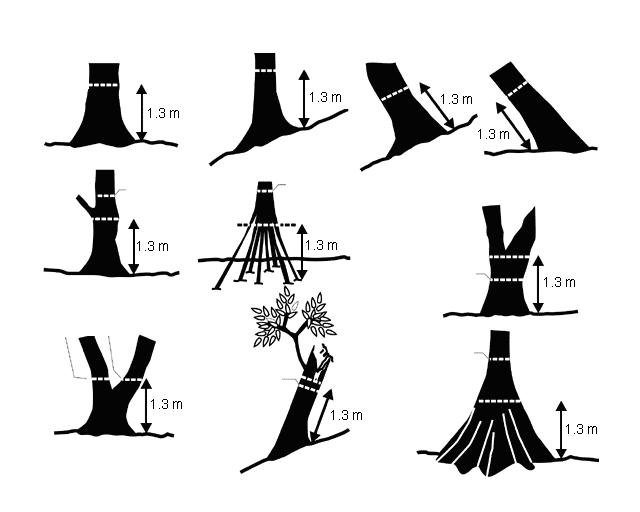
图1 乔木胸径测量位置示意图
(引自Roberts-Pichette & Gillespie,1999)
(4)冠幅:分别测量树冠的长轴长度和短轴长度。树冠边缘的确定是冠幅测量的关键。在确定树冠边缘时特别要注意相邻树木枝叶的干扰,尤其是同一种类树木枝叶的干扰。
(5)地上生物量:采用已公开出版的生物量统计模型进行计算。在实验室进行地上生物量计算时须准确记录样地代码、样方编号、物种名称及生物量数值,然后汇入乔木层调查数据表。
(6)地下生物量:采用已公开出版的生物量统计模型进行计算。在实验室进行地下生物量计算时须准确记录样地代码、样方编号、物种名称及生物量数值,然后汇入乔木层调查数据表。
(7)物候期:记录调查时每种植物所处的物候期。具体物候期确定方法参考吴冬秀等(2019)编制的《陆地生态系统生物观测指标与规范》相关内容。
各个监测指标的调查数据填入表3。植物照片号和标本号填入记录表。乔木群落中的灌木层和草本层调查分别使用灌木群落和草本群落调查表进行记录。
表3乔木(层)群落调查表
第 页
样地代码 样方编号 样方尺寸 m× m 盖度 %
调查日期 年 月 日 时 调查者
物种中文名 | 物种学名 | 株高 /m | 胸径 /cm | 冠幅长轴/m | 冠幅短轴/m | 物候期 | 照片号 | 标本号 | 备注 |
| | | | | | | | | |
| | | | | | | | | |
| | | | | | | | | |
| | | | | | | | | |
| | | | | | | | | |
| | | | | | | | | |
| | | | | | | | | |
| | | | | | | | | |
| | | | | | | | | |
2土壤化学特征
2.1土壤取样
土壤取样深度与地下生物量调查取样深度相同,可与地下生物量调查同步操作,土壤取样具体过程如下。
(1)草本群落:在缓冲区调查样方中进行土壤取样,每个样方沿对角线设置3个取样点,每个取样点用土钻取0~70 cm深度土壤,按照0~10 cm、10~20 cm、20~30 cm、30~50 cm、50~70 cm分层取样,各层土样混合后取约200 g装入布袋保存,每个样地合计采集20个土壤样品,样品带回实验室进行理化性质分析。土样中要有土壤标签,含编号、时间、地点等信息。
(2)灌木群落:在缓冲区灌木层调查样方中进行土壤取样,每个样方沿对角线设置3个取样点,每个取样点用土钻取0~70 cm深度土壤,按照0~10 cm、10~20 cm、20~30 cm、30~50 cm、50~70 cm分层取样,各层土样混合后取约200 g装入布袋保存,每个样地合计采集20个土壤样品,样品带回实验室进行理化性质分析。土样中要有土壤标签,含编号、时间、地点等信息。
(3)乔木群落:在缓冲区灌木层调查样方中进行土壤取样,每个样方沿对角线设置3个取样点,每个取样点用土钻取0~70 cm深度土壤,按照0~10 cm、10~20 cm、20~30 cm、30~50 cm、50~70 cm分层取样,各层土样混合后取约200 g装入布袋保存,每个样地合计采集20个土壤样品,样品带回实验室进行理化性质分析。土样中要有土壤标签,含编号、时间、地点等信息。
土壤样品采集相关信息记入表4。土壤样品编号采用“样地代码+采样日期+样方号+采样深度”,如NMZLMP0120200814Q0210,其中,“NMGZLMP01”是样地编号,“20200814”是采样日期,“Q02”是样方编号,“10”是0~10 cm深度的样品(“20”是10~20 cm深度的样品,“30”是20~30 cm深度的样品,“50”是30~50 cm深度的样品,“70”是50~70 cm深度的样品)。
表4土壤样品采集记录表
第 页
调查日期 年 月 日 时 调查者
2.2土壤理化分析
土壤理化分析具体方法可参照潘贤章等(2019)编写的《陆地生态系统土壤观测指标与规范》执行。
3气象特征
气象特征监测指标包括年日照时数、年均温、生长季月均温、极端最高气温、极端最低气温、>10℃有效积温、年均降水量、生长季月均降水量和降水日数等9个指标。气象数据可以引用距离样地最近的气象观测站的数据,或者由附近的一些站点进行推算。
4植物和土壤标本
4.1植物标本采集
(1)标本编号、记录单和标签
初次监测和调查时,样地内的每种植物都应采集标本。复查时,对于已经采集了标本的植物可以不再采集标本,新出现的植物应采集标本。对标本要进行编号、制作标签并进行数字化。
①标本编号:采用“样地编码+采集日期+标本顺序号”方式表达。例如NMGZLMP0120200812S001,其中,NMG是内蒙古代码,ZLM是正蓝旗代码,P01是样地编码,20200812是标本采集日期,S001是标本顺序号,即这个标本是2020年8月12日在内蒙古正蓝旗1号样地采集的第一号标本。
②标本采集记录单:标本采集记录单是用于在野外记录标本信息的表格,每份标本都要有对应的标本采集记录单。标本采集记录单需要填写的内容包括标本的中文名、学名、采集地点、经纬度、海拔等信息,具体见图2。采集记录单建议尺寸:18 cm×10 cm。在野外,标本采集记录单应使用铅笔或者其他不容易遇水掉色的笔来填写。

图2 标本采集记录单
③标本标签:标本标签是系在所采集标本上的铭牌,用于记录标本采集编号、采集者、采集地点、生境和采集时间等信息(图3)。标签建议尺寸:7 cm×4 cm。在野外,标本标签应使用铅笔或者其他不容易遇水掉色的笔来填写。

图3 标本标签
标本编号需在样方调查表中标注。最后,生成植物标本信息表。植物标本信息表包括标本编号、样地代码、物种中文名称、物种学名、生境、采集地点、经度、纬度、海拔高度、采集人、采集时间、鉴定人、鉴定时间和保存单位等字段。
(2)标本采集、压制和干燥
在野外,应该尽量完整地采集标本。小的草本和小的木本植物,在有花、果的前提下,还应该带有根、茎、叶。高大的乔木、灌木和草本应该采集营养枝(包括萌蘖枝)和生殖枝,特殊类群需要采集成熟植株的树皮等部位(如桦木科植物),同一号植物一般采集3份标本,每一份标本上均要及时系上采集标签,标签上的编号与采集记录单上的编号一定要一致且唯一。
标本应该被及时压制在标本夹中,如果时间较紧迫,也可以暂时保存在塑料袋或采集箱中,并尽快集中压制,但要保证叶片、花瓣等不因萎蔫而皱缩不展。压制标本时短于38 cm的标本(长不超过台纸的长度)可以直接放在吸水纸中压制,长于38 cm的标本可以折成“V”“N”“W”型,但要保证叶片正面、背面均有朝上的,花有正面和背面均展开的,这便于进一步的观察、鉴定。对于体积较大的果实可以切片。大的树叶可以沿中脉切去一半或部分,但要保证叶缘、叶先端、叶基部、叶柄的基本形态的可观察性。
标本可以采用自然干燥和人工加热干燥两种方式进行干燥处理。
①自然干燥:要及时更换吸水纸,直至标本干燥为止。
②人工加热干燥:将初步压制失水的标本放置在具有一定数量瓦楞纸的干燥标本夹中,通常是一张瓦楞纸与一叠吸水纸夹上一份标本相互交替,将标本夹放置在干燥箱或用帆布遮掩,用热气吹风机鼓风,加速标本的干燥。
(3)标本制作与保存
最终要将压制和干燥后的标本装订在台纸上,标准台纸的大小是29 cm×41.5 cm。
① 装订的方法:
a用线将标本直接缝到台纸上;
b用乳胶涂在标本的背面,然后将标本粘在台纸上,在压制数小时待乳胶干燥后即可;
c将乳胶涂在玻璃或硬塑料板上,放上标本,再将粘有胶的标本移到台纸上固定。
在装订标本过程中,标本上掉落的叶、茎、花或果实、种子等碎片要用自制的纸袋包好,一并粘贴在台纸上,不要扔掉。
②粘贴记录单和鉴定标签:将填写完整的标本采集记录单粘贴在台纸的左上角或右上角,鉴定标签(图4)通常粘贴在台纸的右下角,鉴定标签建议尺寸:10 cm×5.5 cm。标本记录单和鉴定标签打印好后粘贴在台纸上或用中性笔填写后再粘贴到台纸上。

图4 鉴定标签
③标本的保存:要将整理好的标本交到有编码的固定标本馆消毒、杀虫后永久保存。
(4)标本的数字化
可以使用相机拍照或标本扫描仪来完成。拍摄时最好使用2000万像素及以上相机,以保证标本照片分辨率在5184×3459=1800万像素以上。
条形码可以使用中国数字植物标本馆(Chinese Virtual Herbarium,CVH)的编号,也可自行拟定或统一使用相应标本存放地标本馆的条形码编号。
拍照时需在标本台纸上放置用于白平衡调试及后期色彩比对的色卡和用于标定影像内植物形态性状尺寸的标尺,两者的摆放位置以不遮挡标本为宜,且位置最好相对固定(图5)。

图5 数字化植物标本(图片来自中国数字植物标本馆)
(5)注意事项
标本分为植物分类学的标本、植被样方调查凭证标本。本监测网的调查是以获取植物群落物种组成、结构等数据为主要目的,采集标本目的主要在于确保调查样方内物种鉴定的准确和后续的纠正。有时候,野外调查难以准确鉴定到种,或者自己认为是某种植物而实际上可能是另外一种外形较相似的物种,以后有标本就可以再校正过来,而没有标本的时候就很难进行校正。在野外进行标本采集时还需要注意以下几个方面。
①用作标本的植株,其根、茎、叶、花和果实最好齐全,压标本需要正、反面叶。作为植被样方的标本,如果样方中的物种不能确定,原则上都要采集标本,无论其是否有花果。
②标本编号一定要与所做样方严格对应,标本编号与样地代码一定要严格对应(其他植物分类的标本除外),样方表中要标注上标本的编号。
③很多植物也可以通过用照相机拍摄主要特征图片,起到标本采集的样方凭证作用,这些图片或者图片集可以称之为植物数字图像标本,具体介绍见4.4.2部分内容。
4.2植物数字图像标本
植物数字图像标本,广义指能体现植物分类学性状的一组植物数字图像,既包括从分类工具书和实物标本等扫描获得的图像,也包括野外或者室内拍摄的能体现植物分类学性状的一组活体植物数字图像(图6至图10)。本节所指的植物数字图像标本主要指后者。植物数字图像标本拍摄内容包括植物生境、整株形态、器官特征三大类,具体拍摄要求可以参考吴冬秀等(2019)编著的《陆地生态系统生物观测指标与规范》第三章的3.10.2节“植物数字图像标本制作规范”。

图6 石生针茅(Stipa tianschanica var. klemenzii)草原分布地形之低山(郭柯2016年8月初摄于新疆巴里坤)

图7 石生针茅(Stipa tianschanica var. klemenzii)草原群落外貌(郭柯2016年8月初摄于新疆巴里坤萨尔乔克乡)

图8 石生针茅(Stipa tianschanica var. klemenzii)草原群落结构(郭柯2016年8月初摄于新疆巴里坤)

图9石生针茅(Stipa tianschanica var. klemenzii)个体花期(赵利清提供)

图10 石生针茅(Stipa tianschanica var. klemenzii)芒形态特征(赵利清提供)
4.3土壤标本
土壤标本采集可参考陈焕伟等(1997)编写的《土壤资源调查》。
5影像资料
影像资料主要包括区域景观图像、植被外貌图像、植被垂直结构图像、地表状况图像和区域景观正射影像等。
区域景观图像可以是采用无人机以一定角度拍摄的图像,或者由人站在高处拍摄的区域景观图像(图11)。植被外貌图像(图12)和植被垂直结构图像(图13)采用数码相机进行拍摄,也可以采用无人机进行低空飞行拍摄,照片要能够反映群落外貌和植物群落的垂直结构。地表状况图像采用数码相机进行拍摄(图14)。
本规范推荐采用无人机拍摄区域景观正射影像,最好包括多光谱图像和普通RGB数码图像(图15为无人机拍摄的RGB正射影像)。无人机需搭载多光谱相机和RGB数码相机,多光谱相机至少包含红、绿、蓝和近红四个波段,RGB数码相机像素不低于2000万。图像获取具体要求如下:以样方的中心点为中心,规划一个不小于100 m ×100 m 的数据采集范围,按照飞行高度(25~30 m)、拍摄方式选择为等时间间隔拍照,旁向重叠度设置为75%,航向重叠率设置为75%,在晴朗无云的条件下进行无人机数据采集。数据采集时应在数据采集范围内(样方中心的90 m× 90 m范围)布设一个标准白板用于数据校准。获取数据后,利用无人机影像处理软件进行数据拼接,生成区域景观的正射影像。

图11 阿尔巴斯针茅草原区域景观图像(陆帅志2018年拍摄)

图12阿尔巴斯针茅草原外貌图像(陆帅志2018年拍摄)

图13 植被垂直结构图像(侯东杰2014年拍摄)

图14 地表状况图像(王孜2019年拍摄)