2025/11/21
点击次数:3990
新技术新方法的应用
1红外热成像技术
1.1 方法概述
红外热成像(infrared thermography,IRT)是一种安全、无创的遥感探测方式,用于探测动物身体表面温度分布模式,红外热成像可以记录地球上所有物体发射的电磁波谱中的红外波。研究对象和生理状态和特性可以通过分析其表面温度分布的图像来评估。在动物研究中,热成像相机因其遥控使用的方式,所以对观察对象不需要进行限制或使用镇静剂,这大大降低了动物的压力水平。热成像在野生动物调查中有诸多应用,如疾病诊断、繁殖过程控制、温度调节研究、动物行为分析、动物探测以及种群大小估算(Cilulko et al., 2013)。
1.2 监测指标
运用红外热成像技术开展兽类监测主要通过手持红像仪、无人机热像仪和固定翼机载热像仪实现,其监测指标体系如表1。
表1 基于红外热成像技术的兽类多样性监测指标体系
指标级别 | 指标类别 | 监测指标 | 测定方法 | 频次 |
一级指标 | 种群 | 种群数量、相对多度、夜栖地偏好 | 手持、无人机、固定翼 | 2~3个月/次, 秋、冬季可加密调查频次 |
群落 | 物种丰富度、多样性指数 | 手持、无人机、固定翼 |
栖息地 | 人类干扰 | 无人机、固定翼 |
二级指标 | 个体 | 多样性、集群、生境选择、行为类型 | 无人机、手持、固定翼 |
动物个体健康状况 | 手持 |
种群 | 数量、密度、种群性比、年龄结构 | 手持、无人机、固定翼 |
疾病流行状况 | 手持 |
群落 | 种间关系、图片指数 | 手持、无人机、固定翼 |
栖息地 | 植被类型、地理特征 | 手持、无人机、固定翼 |
1.3 监测地点与时间
(1)监测地点 依据热像仪的探测距离选择。
(2)监测时间 晚秋、冬季或初春;夜间,日出前2~4 h最佳。但水生兽类由于体温与水温的差距足够大,任何时刻均可利用热像仪开展调查。
1.4 监测工具
手持热像仪、无人机搭载热像仪、固定翼飞机搭载热像仪。
1.5 监测方法与步骤
红外热成像的监测方式较为灵活,其获取热信号的红外热成像仪(以下简称热像仪)可以手持也可以搭载与各种机动平台之上,使用何种方式一般取决于调查对象。我们将通过区分不同监测方式并以该方式调查的物种为例,尽可能清楚简洁的将各个监测方式与各类型动物的调查方法介绍清楚。
(1)手持热像仪 手持热像仪适用于较小区域的兽类调查,调查者搭乘车辆、船等交通工具并操作热像仪并主动搜寻调查区域内的目标动物。
以汽车为例,以皮卡或带天窗汽车为佳。车辆速度根据调查区域的植被类型、高度和密度作相应调整。搜寻没有植被的裸地时会快(15 km/h),搜寻植被较多的场地时会慢一些(5~10 km/h)。在搜索过程中,观测者将肘部固定在一个固定在皮卡上的平台上,同时不断地看着相机(图1)。平台使得观测者维持稳定,从而使得相机保持稳定拍摄。当沿着场地间道路行驶时,相机角度总是与搜寻区域保持垂直,使得观测视角总是处于最佳视角,并尽可能观察前方捕捉热信号。

图1 车辆搭载观测者与热像仪(Karp, 2020)
以船为例。调查时以船为交通工具,利用手持的红外热成像仪进行调查,每天只调查河岸的一侧(图2)。将调查时的船速设定为5~12 km/h,防止过快导致图像模糊或者过慢降低调查效率。除船速外,作者还考虑了以下3个会影响观测结果的因素:船上观测者到河岸的距离(50~100 m)、当天调查时的时间以及天气条件。作者认为最好在下列情况下进行调查:天气晴朗,观测者到目标区域的距离为50~100 m,植被密度低,船速5~12 km/h,时间为清晨时分(周围环境温度最低,环境和动物之间的温差大便于调查记录)。最佳调查时间在清晨4:50—5:30。
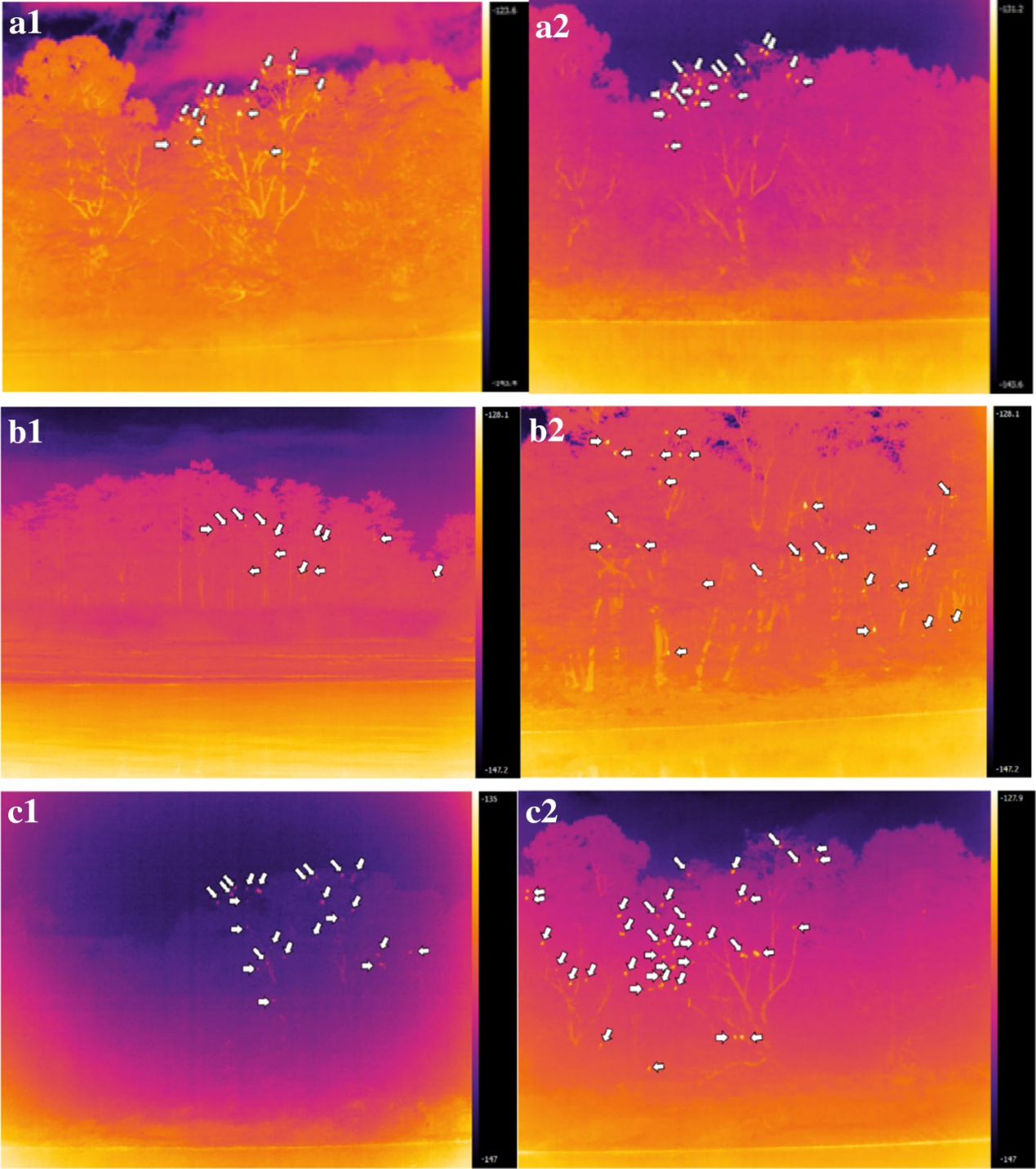
图2 热成像相机拍摄的图像(Jumail et al., 2021)
白色箭头标记的点代表被计数的灵长类动物
从以上案例可以看出,手持热像仪的调查方式选择灵活,同时会根据调查对象和调查地形进行随时调整。操作方面也没有太高的要求,只需要调查人员手持热像仪对准所需调查区域,并对结果进行记录,即可获得目标动物的数量信息或是种群大小信息。同样,手持热像仪的缺点同样明显,即调查范围较小,且因为调查者需要集中精力搜寻目标,因此车辆和船的速度无法加快,建议5~10 km/h好,这一速度也需要根据具体的路况调整,否则一是影响调查结果质量,二是人员无法长时间的高强度调查。
(2)机载热像仪 机载热像仪是目前红外热成像调查中的主流方式,其具有手持热像仪无法比拟的优势,如调查范围更广、效率更高、可以在多种环境和地形条件下使用等。目前,机载热像仪主要搭载两种飞行平台:无人机和固定翼飞机。
①无人机热像仪 根据调查物种以及植被高度确定无人机的飞行高度,以不干扰野生动物并能获得清晰可辨红外热成像图片为准。例如,对蝙蝠类动物的调查飞行高度为50 m左右(McCarthy et al., 2021);对非人灵长类的调查高度主要取决于树木高度,高达200~500 m(He et al., 2020)(图3);而对草原上的大中型有蹄类动物的调查高度80~100 m即可(图4)。
飞行路线的选择可依据调查者熟悉的物种生境偏好手工操作,或利用飞行规划应用程序预先编程处理,自动起飞与降落则使用无人机的自主模式。

图3 秦岭川金丝猴热成像图(He et al., 2020)
左侧每个点代表一只移动的猴子个体

图4 三江源国家公园藏羚热成像图(连新明等,未发表数据)
无人机热成像除开在平原、山地林间可以取得不错的效果以外,在海岸地带也可以用于调查动物个体数量(图5)。如利用无人机热成像仪对新西兰东海岸的海豹进行个体数量调查时指出,无人机载热成像仪在森林郁闭度不超过95%的海豹栖息地中均探测到海豹个体,郁闭度越低,探测效果越好。作者在调查中并未选择某一个时间段,而是在上午、中午及下午都进行了调查,结果显示上午和下午的调查效果较好(Gooday et al., 2018)。这跟前面提到的研究者们普遍选择冬季或者是清晨与晚上不同,这表明,只要动物与周围环境存在足够的温差,红外热成像技术便能很好地完成调查目标。

图5 普通光学相机与红外热成像相机拍摄的海豹照片对比(Gooday et al., 2018)
从以上实例可以看出,无人机载热像仪在调查范围和调查效率上较手持热像仪有了极大的提升,而且也能获得较精确的调查数据。因其无需调查人员一直跟进到调查地点,只需要利用遥控器或是事先编辑好的飞行程序控制无人机进行调查即可。在适用地形上也非常广泛,如平原、山林、海岸等,若是实在没有起飞平台甚至可以人手持无人机放飞。选用无人机进行热成像调查时,需要提前考虑无人机的性能及功能是否满足调查需要,以此制定调查计划比较稳妥。
②固定翼机载热像仪 相比无人机,固定翼飞机续航长、搭载能力强,可以满足大面积、高频度的调查要求。
基本操作流程和搭载热像仪的无人机相似。
航空红外线热成像调查一般用于调查活动范围巨大的动物,随之而来的是调查区域面积也成倍增加,进行此类调查对飞行器的续航和效率有较高的要求,此时手持或是无人机搭载的方式很难完成调查目标,因此需要航程更远的飞行器如固定翼飞机或是直升机。如利用搭载热像仪的固定翼飞机对独角鲸开展航空调查(Florko et al., 2021),将热像仪搭载固定翼飞机,以300 m左右的高度,约203 km/h的速度在总共57条样带合计约3783 km的路径上,成功探测到独角鲸的活动轨迹(图6)。鲸鱼游过后留下的“吸虫印记”可能是鲸鱼上下浮潜时,带动下层温度较高的水与表面温度较低的水发生交换,从而产生温差形成的,而这正是热像仪判别是否有独角鲸活动踪迹的依据。同样,搭载热像仪的固定翼飞机也特别适合大型有蹄类动物的调查,如在美国大峡谷国家公园北缘的鲍威尔高原对野牛的调查去得到较好的效果,可以真实反映该地区野牛的种群大小(Hennig et al., 2021)。
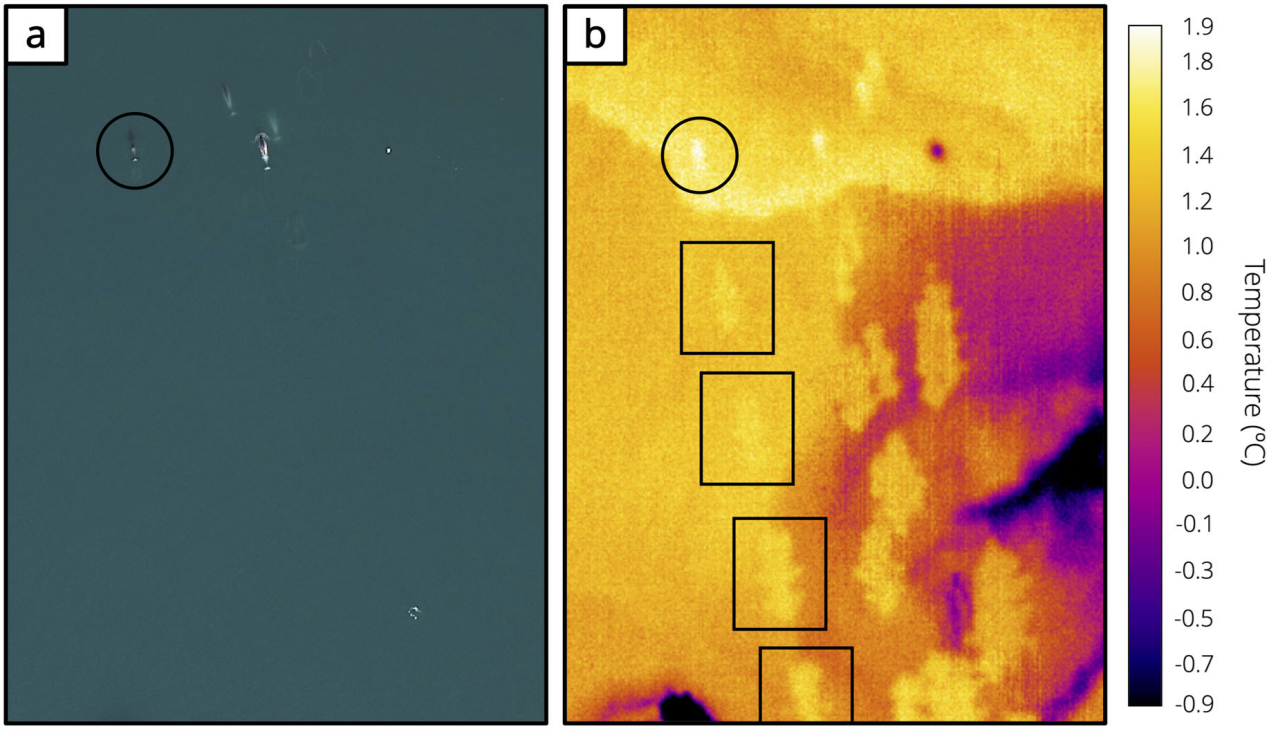
图6 独角鲸吸虫印记的普通照片与红外热成像照片对比(Florko et al., 2021)
圆圈为独角鲸,方框为独角鲸留下的吸虫印记
固定翼飞机搭载热像仪适合大范围、无目标式的动物调查,因其飞行速度较快,无法获得精细的调查数据,但对于大范围内的动物或是其踪迹调查具有较高的效率,可以作为后续调查的基础。
1.6 结果描述
红外热成像也是图像的一种,热像仪采集的数据多为图片或者视频格式,建议无论是图片还是视频都统一处理保存为JPEG图片格式(*.jpeg /*.jpg),该格式文件具有高压缩比的同时还能保留大量图片细节,也是目前使用率最高的图像格式,非常便于交流和传输。数据储存时可按不同样区网格进行储存,又因红外热成像调查一般较少重复,所以推荐记录好当次的飞行数据、生境信息以及地形地貌信息。其他想要用来进行分析的数据可依据自身需要灵活选择。所记录信数据均应形成电子信息存档(具体可参考现行红外相机数据管理办法)。
处理完的图像信息,应保存于研究者个人的硬盘或其他存储设备里,便于随时查阅调取。未来如能建设公共的存储空间则更好,研究者们可以更方便地交流图像数据,也利于数据集中做更深入地分析。
对于大多数动物种群的数量调查研究,经红外热像仪收集数据后,可以通过人工方式在红外热成像图片中分辨并计数拍到的物种及数量。人工方式是目前最常用的图片处理方式,准确率高,但对识别图片的人员要求较高,且存在效率较低的问题。也可利用一些算法,如远距离物体检测的算法Distant-YOLO (Ulhaq et al., 2021) ,可极大提高效率,但算法的正确率与数据源的多少存在密切相关,随着数据源的内容日益增多,识别率也将得到较大提升。
在野生动物调查当中,动物数量很多时候只是调查的目的之一,还需要讨论动物与周围环境的关系,如栖息地质量、植被类型、食物资源、人为打扰等因素,都会直接或间接的影响的动物种群的分布以及数量,因此可将动物数量与这些影响因素结合起来讨论。此时,广义线性混合模型(generalized linear mixed model,GLMM )可以很好地解释随机效应对调查结果的影响,非常适合用于处理野生动物调查时遇到的各种问题。
1.7 注意事项
通过对以上三种热像仪搭载平台的分析,可以得到无论是调查范围还是调查精度亦或是对人员的要求等方面,无人机搭载热像仪都是最合适的,能够满足大部分场景下的调查需要。
无人机载热像仪调查方式建议:
(1) 调查季节建议选择秋冬落叶季,调查时间则建议选择在日出前或者日落后,此时动物大多处于活动低谷,便于寻找,另外此时的环境温度较低,易于通过热像仪发现目标动物。理论上来说,进行调查时目标动物与周围环境之间的温差越大越好。
(2) 无人机飞行高度通常我们建议依据调查区域的乔木高度、动物所处位置及体型大小而定,在乔木高度一定的情况下,动物体型越小,所处位置越低则在保证飞行安全的前提下,高度也应越低,可根据实际情况设置为50~200 m。
(3) 无人机飞行时的速度可以设置慢、中、快三挡,分别对应5 m/s、10 m/s、15 m/s,也可在此基础上根据实际进行增加或减少。除非必要,最大不应超过20 m/s,否则有较大撞机或失控风险。
(4) 飞行时的飞控建议采用遥控式,若对调查区域足够了解,且无人机也具备巡航功能,可以事先编辑好飞行路线,由无人机自动完成区域扫描取样。
(5) 调查时的天气条件比较重要,应该避开雨雾、高温等影响温度探测或温度差异的天气。
但同时无人机载热像仪的使用具有一定门槛,使用者需要事先学习无人机的飞行控制、热像仪功能使用或是飞行程序编辑等,事先做好人员培训与计划。
2肠道微生物
2.1 方法概述
细菌、真菌和病毒等微生物寄居在狭长的肠道中,其个体数量和基因数量远远大于宿主本身的细胞数量和基因数量,对宿主消化吸收、免疫应答、行为调控等方面产生重大的影响。较早的研究往往采取室内培养法去阐明微生物的种类及功能,但肠道菌群多是厌氧菌,且培养基营养比例难以确定,培养法仅仅能培养出极低比例的种类,对于理解整个肠道菌群群落的组成、功能及相互作用有着较大的局限性。随着二代和三代测序技术的发展和推广,我们可以在不培养的情况下以高通量的方式认识肠道菌群组成和功能。16S rDNA基因存在与所有细菌的基因组中,序列全长约1500 bp,共包含9个高变区。扩增子测序是利用二代/三代测序平台,通过对16S rDNA基因某一段高变区(V4区或V3+V4区)进行PCR高通量扩增测序。通过质控、拼接、去除嵌合体和序列比对后,即可获得样品中微生物的群落结构(即菌群组成和相对丰度),进化关系以及肠道菌群与环境因素的相关关系。通过比较肠道菌群物种多样性大小和病原微生物的组成比例,可判断该个体的健康情况。
2.2 监测指标
基于扩增子测序技术的兽类多样性监测指标体系如表2。
表2 扩增子测序技术监测指标体系
指标级别 | 指标类别 | 监测指标 | 测定方法 | 频次 |
一级指标 | Alpha多样性 | OTUs丰富度 | QIIME2或者R软件 | |
Chao1指数 | QIIME2或者R软件 | |
Shannon指数 | QIIME2或者R软件 | |
Faith’s谱系多样性 | QIIME2或者R软件 | |
Beta多样性 | Bray-Curtis距离 | QIIME2或者R软件 | |
Jaccard距离 | QIIME2或者R软件 | |
Weighted Unifrac距离 | QIIME2或者R软件 | |
Unweighted Unifrac距离 | QIIME2或者R软件 | |
二级指标 | 物种组成 | 相对丰度 | QIIME2 | |
绝对丰度 | QIIME2 | |
群落组装 | 随机性过程 | R软件 | |
确定性过程 | R软件 | |
网络结构 | 度 | R软件 | |
连接数 | R软件 | |
模块化 | R软件 | |
正负连接比例 | R软件 | |
2.3 监测地点与时间
与动物监测保持同步。
2.4 监测工具
镊子、无菌EP管、干冰盒/液氮罐(或带菌群固定液的EP管)。
2.5 监测方法与步骤
(1)研究对象的选取,搜集新鲜粪便。对于大型动物而言,我们可直接在野外选定研究对象排出的新鲜粪团,用小勺取内部的新鲜部分,然后放到无菌EP管内冷冻保存。对于小型动物,可将捕获的活体个体放置到灭菌过的白色整理箱中,让动物个体自然排便(应激状态下很快就能排出粪便)。用⽆菌牙签或者灭菌的镊子收集新鲜的粪便,放置于1.5 mL的无菌EP中,闭上管盖,做好标记,随即放置于液氮罐中或干冰保存。排便过程中,要及时采集鼠类粪便,避免鼠个体将粪便踩踏污染或尿液污染。
(2) 提取基因组DNA,DNA浓度需要达到5 ng/uL,总量需要大于等于150 ng。
(3)构建PCR-free文库。
(4)测序。
(5)生物信息学分析。
2.6 结果描述
记录样品采集物种,生境类型,性别、体重等基本信息。
2.7 注意事项
(1)须捕获活体,采集新鲜的粪便样品才能保证肠道菌群数据的准确性;
(2)在同一天的不同时间段,肠道菌群存在组成上的差异;因此要保证采集时间的统一性(上午排粪量较大,可集中在上午采集);
(3)采取下一只个体粪便的时候,需要乙醇擦拭镊子或者换一根新的牙签,避免不同个体之间粪便污染。如果粪便有便血的情况,需要做好记录。
(4)样品全部采集后,应尽快用干冰运输到实验室中。若无法实现低温保存,则可购置粪便微生物DNA常温保存液。注意在样本冻存及运输期间,请勿反复冻融。
(5)原则上样品量多多益善,最低一般不低于0.2 g。实际操作中,对于小型啮齿动物来讲,由于不同动物的粪便颗粒大小不同,以布氏田鼠为例(成体30~50 g),2~3粒粪便即可满足扩增子测序要求;小鼠(成体20 g左右)大致需要采集6~8粒。
参考文献
1. Arenas AJ, Gómez F, Salas R, et al. An evaluation of the application of infrared thermal imaging to the tele-diagnosis of sarcoptic mange in the Spanish ibex (Capra pyrenaica) [J]. Veterinary Parasitology, 2002, 109(1-2): 111-117.
2. Batista PHD, Almeida GLP, Pandorfi H, et al. Thermal images to predict the thermal comfort index for Girolando heifers in the Brazilian semiarid region [J]. Livestock Science, 2021, 251: 104667.
3. Bissonnette PB, Waterman JM, Petersen SD. The use of infrared thermography to noninvasively measure the surface temperature of polar bears during bouts of social play [J]. Zoo Biology, 2022, 42(1): 38-44.
4. Boileau A, Farish M, Turner SP, et al. Infrared thermography of agonistic behaviour in pigs [J]. Physiology and Behavior, 2019, 210: 112637.
5. Cilulko J, Janiszewski P, Bogdaszewski M, et al. Infrared thermal imaging in studies of wild animals [J]. European Journal of Wildlife Research, 2013, 59(1): 17-23.
6. Dezecache G, Wilke C, Richi N, et al. Skin temperature and reproductive condition in wild female chimpanzees [J]. PeerJ, 2017, 5: e4116.
7. Dezecache G, Zuberbuhler K, Davila-Ross M, et al. Skin temperature changes in wild chimpanzees upon hearing vocalizations of conspecifics [J]. Royal Society Open Science, 2017, 4(1): 160816.
8. Florko KRN, Carlyle CG, Young BG, et al. Narwhal (Monodon monoceros) detection by infrared flukeprints from aerial survey imagery [J]. Ecosphere, 2021, 12(8): e03698.
9. Gooday OJ, Key N, Goldstien S, et al. An assessment of thermal-image acquisition with an unmanned aerial vehicle (UAV) for direct counts of coastal marine mammals ashore [J]. Journal of Unmanned Vehicle Systems, 2018, 6(2): 100-108.
10. Guo K, Liu H, Bao H, et al. Habitat selection and their interspecific interactions for mammal assemblage in the Greater Khingan Mountains, northeastern China [J]. Wildlife Biology, 2017(4): 261.
11. He G, Yang H, Pan R, et al. Using unmanned aerial vehicles with thermal-image acquisition cameras for animal surveys: a case study on the Sichuan snub-nosed monkey in the Qinling Mountains [J]. Integrative Zoology, 2020, 15(1): 79-86.
12. Hennig JD, Schoenecker KA, Terwilliger ML, et al. Comparison of aerial thermal infrared imagery and helicopter surveys of Bison (Bison bison) in Grand Canyon National Park, USA [J]. Sensors, 2021, 21(15): 5087.
13. Jakubas D, Wojczulanis-Jakubas K, Grissot A, et al. Eye region surface temperature and corticosterone response to acute stress in a high-arctic seabird, the little auk [J]. Animals, 2022, 12(4): 499.
14. Jumail A, Liew TS, Salgado-Lynn M, et al. A comparative evaluation of thermal camera and visual counting methods for primate census in a riparian forest at the Lower Kinabatangan Wildlife Sanctuary (LKWS), Malaysian Borneo [J]. Primates, 2021, 62(1): 143-151.
15. Karp D. Detecting small and cryptic animals by combining thermography and a wildlife detection dog [J]. Scientific Reports, 2020, 10(1): 5520.
16. McCarthy ED, Martin JM, Boer MM, et al. Drone‐based thermal remote sensing provides an effective new tool for monitoring the abundance of roosting fruit bats [J]. Remote Sensing in Ecology and Conservation, 2021, 7(3): 461-474.
17. Polit M, Rzasa A, Rafajlowicz W, et al. Infrared technology for estrous detection in Chinchilla lanigera [J]. Animal Reproduction Science, 2018, 197: 81-86.
18. Rizzo M, Arfuso F, Alberghina D, et al. Monitoring changes in body surface temperature associated with treadmill exercise in dogs by use of infrared methodology [J]. Journal of Thermal Biology, 2017, 69: 64-68.
19. Sathiyabarathi M, Jeyakumar S, Manimaran A, et al. Infrared thermography: a potential noninvasive tool to monitor udder health status in dairy cows [J]. Veterinary World, 2016, 9(10): 1075-1081.
20. Schoenecker KA, Doherty PF, Jr. Hourt JS, et al. Testing infrared camera surveys and distance analyses to estimate feral horse abundance in a known population [J]. Wildlife Society Bulletin, 2018, 42(3), 452-459.
21. Spaan D, Burke C, McAree O, et al. Thermal infrared imaging from drones offers a major advance for spider monkey surveys [J]. Drones, 2019, 3(2): 34.
22. Spiegel O, Leu ST, Sih A, et al. When the going gets tough: behavioural type-dependent space use in the sleepy lizard changes as the season dries [J]. Proceedings of the Royal Society B: Biological Sciences, 2015, 282(1819): 20151768.
23. Travain T, Valsecchi P. Infrared thermography in the study of animals' emotional responses: a critical review [J]. Animals, 2021, 11(9): 2510.
24. Ulhaq A, Adams P, Cox TE, et al. Automated detection of animals in low-resolution airborne thermal imagery [J]. Remote Sensing, 2021, 13(16): 3276.
25. Yanmaz LE, Okumus Z, Dogan E. Instrumentation of thermography and its applications in horses [J]. Journal of Animal and Veterinary Advances, 2007, 6(7), 858-862.